Introduzione
Lo zirconio è l'elemento chimico di numero atomico 40. Appartiene perciò ai metalli nella tavola periodica. Il suo simbolo è Zr. È un metallo di transizione bianco-grigio, duro, il cui aspetto ricorda quello del titanio. Viene ottenuto soprattutto dallo zircone ed è molto resistente alla corrosione. Le leghe metalliche di zirconio sono largamente impiegate negli impianti nucleari a causa della bassa sezione di assorbimento per i neutroni, sia come rivestimento del combustibile nucleare che nelle strutture di sostegno del nocciolo, e inoltre per la loro resistenza alla corrosione in acqua.
Storia
Lo zirconio (dall'arabo zarkûn, a sua volta derivato dal persiano zargûn, "simile all'oro") fu scoperto nel 1789 da Martin Heinrich Klaproth e isolato nel 1824 da Jons Jakob Berzelius.
I minerali dello zirconio – ovvero lo zircone, la zirconite e lo zaffiro – erano noti nell'antichità e sono menzionati nelle scritture bibliche. Fu però l'analisi di Klaproth di uno zaffiro proveniente da Sri Lanka (allora Ceylon) a rivelare che questo minerale conteneva un elemento ancora sconosciuto, che egli battezzò Zirkonertz
Il metallo fu isolato in forma impura da Berzelius, che lo preparò scaldando una miscela di potassio e di fluoruro di zirconio e potassio in un tubo di ferro, provocandone la decomposizione. Lo zirconio puro fu ottenuto per la prima volta nel 1914.
Disponibilità
Lo zirconio non si trova mai in natura come metallo puro, ma sotto forma di ossidi di zirconio la principale fonte commerciale di zirconio è il minerale di silicato di zirconio, lo zircone (ZrSiO4), che si trova in giacimenti situati in Australia, Brasile, India, Russia e negli Stati Uniti (è estratto come una polvere scura e fuligginosa, o come una sostanza cristallina, di un grigio metallico). Lo zirconio e l'afnio sono contenuti nello zircone in rapporto di 50 a 1 e sono molto difficili da separare. Lo zirconio è anche un sottoprodotto dello sfruttamento minerario e della lavorazione di sabbie minerali come la menaccanite, la ilmenite e il rutilo, o minerali di stagno. Lo zirconio è pure contenuto in altre 30 specie minerali note, compresa la baddeleyite. Il metallo si ottiene commercialmente per riduzione del tetracloruro con magnesio nel processo Kroll o per decomposizione termica su un filamento di tungsteno scaldato a circa 1300 °C del tetraioduro (processo van Arkel-de Boer) e attraverso altri metodi. Lo zirconio di qualità commerciale contiene ancora dall'1% al 3% di afnio.
Questo elemento è anche abbondante nelle stelle di tipo S, ed è stato rilevato nel sole e nelle meteoriti. I campioni di rocce lunari portati sulla terra dalle missioni apollo hanno un contenuto di ossido di zirconio molto più alto rispetto a quelle terrestri.

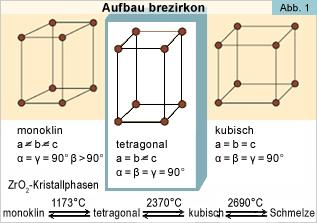
Lo ZrO2 puro ha una struttura cristallina monoclina a temperatura ambiente e a temperature elevate presenta transizioni a tetragonale e cubico. L'espansione di volume causata dalla transizione da cubico a tetragonale a monoclina induce sforzi molto grandi e quindi lo ZrO2 tende a fessurarsi durante raffreddamenti bruschi.
Per ovviare a questo problema, vengono aggiunti ossidi di vario tipo per stabilizzare le fasi tetragonali e/o cubiche: ossido di magnesio (MgO), ossido dell'ittrio (YO) e ossido di calcio (CaO). Nel dentale viene usato maggiormente la formula Y-TZP che non è altro una stabilizzazione dell'ossido di zirconio con Yttrium (3%). In alcuni casi, la fase tetragonale può essere metastabile. Se le quantità della fase tetragonale metastabile è sufficiente, applicando uno sforzo si ha una concentrazione di sforzo all’apice della cricca che può indurre la transizione da fase tetragonale a monoclina, con l'espansione di volume collegata. Questa trasformazione di fase mette la cricca in compressione, ritardando la relativa propagazione ed aumentando la resistenza a frattura. Questo meccanismo estende l'affidabilità ed il corso della vita dei prodotti fatti con la zirconia stabilizzata. Un caso speciale della zirconia è quello della zirconia policristallina o di TZP tetragonale.
Utilizzo nel dentale
Tutte le caratteristiche fisico-chimiche dello zirconio
- Atomic Number: 40
- Group: 4
- Period: 5
- Series: Transition Metals
Zirconium's Name in Other Languages
- Latin: Zirkonium
- Czech: Zirkonium
- Croatian: Cirkonij
- French: Zirkonium
- German: Zirkonium – s
- Italian: Zirconio
- Norwegian: Zirkonium
- Portuguese: Xircônio
- Russian: Цирконий
- Spanish: Circonio
- Swedish: Zirkonium
Atomic Structure of Zirconium
- Atomic Radius: 2.16Å
- Atomic Volume: 14.1cm3/mol
- Covalent Radius: 1.45Å
- Cross Section (Thermal Neutron Capture)σa/barns: 0.184
- Crystal Structure: Hexagonal
- Electron Configuration:
- 1s2 2s2p6 3s2p6d10 4s2p6d2 5s2
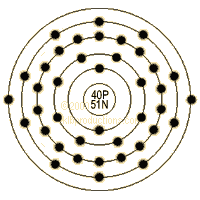
- Electrons per Energy Level: 2,8,18,10,2
- Ionic Radius: 0.72Å
- Filling Orbital: 4d2
- Number of Electrons (with no charge): 40
- Number of Neutrons (most common/stable nuclide): 51
- Number of Protons: 40
- Oxidation States: 4
- Valence Electrons: 4d2 5s2
- Electron Dot Model
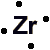
- Electron Dot Model
Chemical Properties of Zirconium
- Electrochemical Equivalent: 0.8509g/amp-hr
- Electron Work Function: 4.05eV
- Electronegativity: 1.33 (Pauling); 1.22 (Allrod Rochow)
- Heat of Fusion: 16.9kJ/mol
- Incompatibilities:
- Potassium nitrate, oxidizers
- Ionization Potential
- Valence Electron Potential (-eV): 80
Physical Properties of Zirconium
- Atomic Mass Average: 91.224
- Boiling Point: 4650K 4377°C 7911°F
- Coefficient of lineal thermal expansion/K-1: 5.78E-6
- Conductivity
- Electrical: 0.0236 106/cm Ω
Thermal: 0.227 W/cmK
- Electrical: 0.0236 106/cm Ω
- Density: 6.51g/cc @ 300K
- Description:
- A hard Rare grayish-white metal, which is resistant towards corrosion due to an oxide film on its surface. It will burn in air if ignited.
- Elastic Modulus:
- Bulk: 89.8/GPa
- Rigidity: 35/GPa
- Youngs: 98/GPa
- Enthalpy of Atomization: 598 kJ/mole @ 25°C
- Enthalpy of Fusion: 20.9 kJ/mole
- Enthalpy of Vaporization: 581.6 kJ/mole
- Flammablity Class: Combustible
- Freezing Point: see melting point
- Hardness Scale
- Brinell: 650 MN m-2
- Mohs: 5
- Vickers: 903 MN m-2
- Heat of Vaporization: 58.2kJ/mol
- Melting Point: 2125K 1852°C 3366°F
- Molar Volume: 14.06 cm3/mole
- Physical State (at 20°C & 1atm): Solid
- Specific Heat: 0.27J/gK
- Vapor Pressure = 0.00168Pa@1852°C
Regulatory / Health
- CAS Number
- 7440-67-7 powder, wet
- UN/NA ID and ERG Guide Number
- RTECS: ZH7070000
- OSHA Permissible Exposure Limit (PEL)
- TWA: 5 mg/m3
- OSHA PEL Vacated 1989
- NIOSH Recommended Exposure Limit (REL)
- Routes of Exposure: Inhalation; Skin and/or eye contact
- Target Organs: Skin, respiratory system
- Levels In Humans:
Note: this data represents naturally occuring levels of elements in the typical human, it DOES NOT represent recommended daily allowances.- Blood/mg dm-3: 0.011
- Bone/p.p.m: <0.1
- Liver/p.p.m: 0.11
- Muscle/p.p.m: 0.08
- Daily Dietary Intake: 0.05 mg
- Total Mass In Avg. 70kg human: 1 mg
Who / Where / When / How
- Discoverer: Martin H. Klaproth
- Discovery Location: Berlin Germany
- Discovery Year: 1789
- Name Origin:
- Farsi, zargun for gold color.
- Abundance of Zirconium:
- Earth's Crust/p.p.m.: 190
- Seawater/p.p.m.: 0.000009
- Atmosphere/p.p.m.: N/A
- Sun (Relative to H=1E12): 560
- Sources of Zirconium:
- Found in many minerals such as zircon and baddeleyite. Annual world wide production is around 7000 tons. Primary mining areas are Australia, Brazil, USA and Sri Lanka.
- Uses of Zirconium:
- Used in alloys such as zircaloy which is used in nuclear applications since it does not readily absorb neutrons. Also used in catalytic converters, percussion caps and furnace bricks. Baddeleyite is used in lab crucibles.
- Additional Notes:
- While Klaproth discovered zirconium in 1789, it first isolated by J.J. Berzelius in 1824 in stockholm Sweden.